Жирные кислоты мембран эритроцитов в дифференцировании пациентов с жировой болезнью печени алкогольного, неалкогольного и смешанного генеза
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Обследованы 38 мужчин (средний возраст – 47,5 ± 2,9 года) с неалкогольной жировой болезнью печени (НАЖБП), 31 мужчина с алкогольной жировой болезнью печени (АЖБП) (45,1 ± 3,1 года) и 30 мужчин (48,2 ± 3,2 года) с жировой болезнью печени смешанного генеза (метаболический + алкогольный). Степень фиброза в группах не превышала I. Исследование состава и уровней ЖК мембран эритроцитов проведено с помощью газовой хроматографии/масс-спектрометрии – системы на основе трех квадруполей Agilent 7000B (США).
Результаты. Уровни элаидиновой, 9-пальмитолеиновой, эйкозапентаеновой ЖК были выше (p = 0,041–0,058), а содержание маргариновой, стеариновой и альфа-линоленовой кислот (p = 0,043–0,05) – ниже при алкогольном генезе по сравнению с неалкогольным. Использование панели жирных кислот – C18:1;t9, C17:0, С18:0, С18:3 n-3, С16:1;9, С20:5 n-3 – обеспечило высокую диагностическую точность с AUC 0,914, чувствительностью 81%, специфичностью 93% при различении НАЖБП от АЖБП.
Установлено, что суммарное содержание ненасыщенных ЖК (ННЖК), мононенасыщенных ЖК, уровни арахидоновой (n-6), олеиновой, эйкозапентаеновой (n-3), пальмитолеиновой, элаидиновой ЖК, суммарное содержание двух n-3 полиненасыщенных ЖК (ПНЖК) – эйкозапентаеновой и докозагексаеновой – у пациентов с жировой болезнью печени смешанного генеза статистически значимо выше, а уровни стеариновой, суммарного содержания насыщенных ЖК (НЖК), арахиновой ЖК и соотношения НЖК/ННЖК, НЖК/ПНЖК – ниже, чем у пациентов с НАЖБП (p = 0,000004–0,04).
У пациентов с жировой болезнью печени смешанного генеза значимо выше суммарное содержание мононенасыщенных ЖК, особенно олеиновой и пальмитолеиновой, омега-6 ПНЖК – линолевой и насыщенной лауриновой – и ниже уровни насыщенных ЖК арахиновой, стеариновой, соотношения НЖК/ННЖК, НЖК/ПНЖК, чем при АЖБП (p = 0,0009–0,06).
Заключение. Выявленные различия в уровнях жирных кислот мембран эритроцитов у пациентов с жировой болезнью печени различного генеза, вероятно, ассоциированы с основным этиологическим фактором и могут быть использованы для разработки новых методов диагностики, таргетов для терапии.
Материал и методы. Обследованы 38 мужчин (средний возраст – 47,5 ± 2,9 года) с неалкогольной жировой болезнью печени (НАЖБП), 31 мужчина с алкогольной жировой болезнью печени (АЖБП) (45,1 ± 3,1 года) и 30 мужчин (48,2 ± 3,2 года) с жировой болезнью печени смешанного генеза (метаболический + алкогольный). Степень фиброза в группах не превышала I. Исследование состава и уровней ЖК мембран эритроцитов проведено с помощью газовой хроматографии/масс-спектрометрии – системы на основе трех квадруполей Agilent 7000B (США).
Результаты. Уровни элаидиновой, 9-пальмитолеиновой, эйкозапентаеновой ЖК были выше (p = 0,041–0,058), а содержание маргариновой, стеариновой и альфа-линоленовой кислот (p = 0,043–0,05) – ниже при алкогольном генезе по сравнению с неалкогольным. Использование панели жирных кислот – C18:1;t9, C17:0, С18:0, С18:3 n-3, С16:1;9, С20:5 n-3 – обеспечило высокую диагностическую точность с AUC 0,914, чувствительностью 81%, специфичностью 93% при различении НАЖБП от АЖБП.
Установлено, что суммарное содержание ненасыщенных ЖК (ННЖК), мононенасыщенных ЖК, уровни арахидоновой (n-6), олеиновой, эйкозапентаеновой (n-3), пальмитолеиновой, элаидиновой ЖК, суммарное содержание двух n-3 полиненасыщенных ЖК (ПНЖК) – эйкозапентаеновой и докозагексаеновой – у пациентов с жировой болезнью печени смешанного генеза статистически значимо выше, а уровни стеариновой, суммарного содержания насыщенных ЖК (НЖК), арахиновой ЖК и соотношения НЖК/ННЖК, НЖК/ПНЖК – ниже, чем у пациентов с НАЖБП (p = 0,000004–0,04).
У пациентов с жировой болезнью печени смешанного генеза значимо выше суммарное содержание мононенасыщенных ЖК, особенно олеиновой и пальмитолеиновой, омега-6 ПНЖК – линолевой и насыщенной лауриновой – и ниже уровни насыщенных ЖК арахиновой, стеариновой, соотношения НЖК/ННЖК, НЖК/ПНЖК, чем при АЖБП (p = 0,0009–0,06).
Заключение. Выявленные различия в уровнях жирных кислот мембран эритроцитов у пациентов с жировой болезнью печени различного генеза, вероятно, ассоциированы с основным этиологическим фактором и могут быть использованы для разработки новых методов диагностики, таргетов для терапии.




Введение
Жировая болезнь печени (ЖБП) (жировой гепатоз, стеатоз, жировая инфильтрация, жировая дистрофия печени) – это хроническое заболевание, при котором происходят накопление жировых компонентов в нормальных клетках печени, перерождение гепатоцитов в жировую ткань, то есть ожирение печени. Эта патология весьма распространена с тенденцией к росту как в России (~37,3%, данные DIREG 2, 2015) [1, 2], так и в странах Европы, США (20–33%) [3]. ЖБП включает в себя алкогольную жировую болезнь печени (АЖБП), которая связана с употреблением пациентами этанола в гепатотоксичных дозах, и неалкогольную – НАЖБП (первичную), ассоциированную с метаболическим синдромом (после исключения других неалкогольных этиологических факторов) [4].
В связи с общностью морфологических изменений, звеньев патогенеза, метаболических нарушений, перекреста предрасполагающих факторов было предложено выделить новую нозологическую форму – метаболически ассоциированную ЖБП (metabolic associated fatty liver disease, MAFLD) [5].
Вместе с тем в ряде исследований убедительно показано, что НАЖБП и АЖБП имеют различия по рискам развития ряда патологий. Так, НАЖБП признана независимым фактором риска сердечно-сосудистой смерти, риск которой возрастает в 3,2 раза при выявлении стеатоза, по данным УЗИ [6].
Установлено, что самая ранняя стадия НАЖБП – стеатоз знаменует собой глубокое метаболическое нарушение, которое может отражаться не только на сердечно-сосудистых рисках, но даже на объеме мозга (данные МРТ, Фрамингемское исследование) [7].
Показано, что НАЖБП – независимый фактор прогрессирования риска сердечно-сосудистых заболеваний из-за значительного совпадения прогрессирующей НАЖБП и высокого риска сердечно-сосудистой патологии, активное лечение стеатоза позволит улучшить жизненный прогноз у этих пациентов [8].
В то же время исследования Y. Jia и соавт. (2019) продемонстрировали более высокий потенциал прогрессирования в аденокарциному АЖБП по сравнению с неалкогольной [9]. Другие авторы продемонстрировали большие темпы прогрессирования фиброза печени в случаях алкогольного генеза заболевания [10], что может быть установлено неинвазивными методами, включая непрямую эластометрию. Однако для выявления различной скорости развития фиброза печени у пациентов с алкогольным и неалкогольным генезом заболевания необходимо наблюдение в динамике, начальный же уровень фиброза может быть сходным.
В литературе обсуждается новый термин «стеатотическая болезнь печени» (SLD), которая включает лиц с признаками метаболического синдрома, потребляющих количество алкоголя в неделю, большее чем 140 г для женщин и 210 г для мужчин, – MetALD. Потенциал прогрессирования данной патологии требует дальнейших исследований [11].
В патогенезе НАЖБП ключевую роль играет увеличение поступления свободных жирных кислот (СЖК) в печень, снижение скорости β-окисления СЖК и повышение синтеза жирных кислот в митохондриях печени. СЖК являются высокоактивным субстратом перекисного окисления липидов (ПОЛ). Основанием рассматривать ПОЛ как универсальный патогенетический механизм развития неалкогольного стеатогепатита (НАСГ) служит тот факт, что эффектами ПОЛ можно объяснить основную часть наблюдаемых при стеатогепатите воспалительно-некротических изменений в печени [12]. НАСГ может прогрессировать до цирроза и гепатоцеллюлярной карциномы [13], поэтому усилия по диагностике и лечению должны быть направлены на людей с этой патологией [13, 14].
В развитии и прогрессировании НАЖБП остается целый ряд неясных аспектов. Накопление липидов является центральной особенностью НАЖБП и обусловлено множеством факторов, начиная с увеличения потока жирных кислот и заканчивая липогенезом de novo. Повышенный липогенез является основной характеристикой НАЖБП и, по-видимому, более важным источником стеатоза, чем избыточное поступление липидов в составе диеты [15, 16]. K. Muir и соавт. на мышиной модели НАСГ показали, что у животных, получавших регулярную диету, развивались изменения в составе как печеночных, так и циркулирующих жирных кислот, в соответствии с важной ролью липогенеза de novo при НАСГ [17].
Первоначальное биохимическое объяснение развития алкогольной жировой дистрофии печени основывалось на способности этанола изменять окислительно-восстановительное состояние печени и ингибировать окисление жирных кислот. Последующие исследования показали подавление окисления жирных кислот в митохондриях печеночных клеток и индукцию липогенеза при систематическом потреблении алкоголя [18]. Этанол активирует стерольный регуляторный элемент, связывающий белок 1, индуцируя ряд липогенных ферментов. Эти эффекты могут быть частично обусловлены ингибированием АМФ-зависимой протеинкиназы, снижением уровня адипонектина в плазме крови или повышением уровня фактора некроза опухоли α (ФНО-α) в печени. Данные факторы, в свою очередь, активируют липогенные пути и ингибируют окисление жирных кислот. Помимо синтеза и окисления жирных кислот, этанол также изменяет метаболизм липидных капель (форма хранения триглицеридов) в гепатоцитах и секрецию липопротеидов очень низкой плотности (ЛПОНП) печенью [18]. Поскольку алкогольный стеатоз в настоящее время рассматривается как значительный фактор риска прогрессирования диффузной патологии печени, понимание его молекулярных механизмов, включая липидомический профиль, открывает новые терапевтические мишени для устранения алкогольной жировой дистрофии печени.
В патогенезе неалкогольной и алкогольной ЖБП прослеживаются общие звенья, которые, вероятно, потенцируются при смешанном (метаболический + алкогольный) генезе заболевания. Но вместе с тем имеются различия, связанные с основным этиологическим фактором ЖБП, которые могут быть полезны с точки зрения дифференциальной диагностики.
В проведенных ранее исследованиях нами были получены пилотные данные об особенностях жирно-кислотного профиля мембран эритроцитов и сыворотки крови у пациентов с ЖБП алкогольного и неалкогольного генеза по сравнению со здоровыми обследуемыми [19–21], определения тяжести ЖБП [22]. Полученные результаты оказались перспективными и требующими углубленных исследований с учетом роли жирных кислот в патогенезе ЖБП [23].
Цель – изучить возможности использования жирных кислот мембран эритроцитов в дифференцировании пациентов с ЖБП алкогольного, неалкогольного и смешанного (метаболический + алкоголь) генеза.
Материал и методы
Обследованы 38 мужчин (средний возраст – 47,5 ± 2,9 года) с НАЖБП, 31 мужчина с АЖБП (средний возраст – 45,1 ± 3,1 года) и 30 мужчин (средний возраст – 48,2 ± 3,2 года) с ЖБП смешанного генеза (метаболический + алкогольный) по данным УЗИ органов брюшной полости. В настоящей работе использован термин «алкогольная жировая болезнь печени» (АЖБП), что соответствовало кодам K70.0 – алкогольная жировая дистрофия печени [стеатоз] и K70.1 – алкогольный гепатит по Международной классификации болезней 10-го пересмотра. Термин «неалкогольная жировая болезнь печени» (НАЖБП) соответствовал коду К76.0 – жировая дегенерация печени, не классифицированная в других рубриках [24].
Вирусная этиология заболевания исключена на основании отсутствия серологических маркеров, выявляемых методом иммуноферментного анализа, и/или ДНК и РНК вирусов, обнаруживаемых методом полимеразной цепной реакции.
НАЖБП диагностирована в соответствии с критериями клинических рекомендаций [25], диагноз НАЖБП был подтвержден индексом NAFLD liver fat score [26]. Пациенты эпизодически (один – четыре раза в год) потребляли низкие дозы алкоголя (в среднем 15,8 ± 3,9 г в сутки в пересчете на чистый этанол) или не потребляли спиртные напитки вообще. Данные опросников AUDIT, CAGE, биохимические показатели позволили исключить алкогольную этиологию ЖБП.
Алкогольный генез стеатоза устанавливался по данным достоверно подтвержденного наличия систематического потребления алкоголя в настоящее время и в анамнезе (по данным стандартного опроса, в том числе с помощью CAGE-опросника, AUDIT). Смешанная этиология (метаболическая + алкогольная) диагностировалась в случае регулярного потребления алкоголя пациентами с проявлениями метаболического синдрома согласно рекомендациям экспертов ВНОК [27].
По употреблению алкоголя выделяли следующие группы: 0 – не употребляли в течение последнего года; 1 – употребляли несколько раз в году, но не ежемесячно; 2 – употребляли несколько раз в месяц; 3 – употребляли несколько раз в неделю; 4 – употребляли ежедневно. Относительно безопасной разовой дозой считали 10 г чистого этанола (один дринк) для женщин и 20 г чистого этанола (два дринка) для мужчин [28].
Большая часть обследованных пациентов с АЖБП регулярно потребляла алкоголь (более трех раз в неделю) в течение от 8 до 22 лет, разовая доза потребляемого алкоголя составила 120,73 ± 78,7 г, недельная – 641,87 ± 466,9 г. В момент исследования крови пациенты находились в состоянии абстиненции (в среднем на 4,96 ± 3,3 день), причем доза алкоголя, выпитого накануне, составила 125,32 ± 87,5 г в пересчете на чистый этанол. 27 (87%) человек указали на предпочтение крепких алкогольных напитков (водка, коньяк, виски), остальные потребляли алкогольные напитки различной крепости.
Все пациенты с ЖБП смешанного генеза систематически потребляли алкогольные напитки с частотой более раза в неделю в большей части случаев (27 (87%) человек), с разовой (103,1 ± 62,86 г) и недельной (211,0 ± 133,8 г) дозами в пересчете на чистый этанол в течение в среднем 12,6 ± 5,9 года. Около трети пациентов потребляли крепкие алкогольные напитки (водка), 8 (25,8%) человек предпочитали пиво, в 6 (19,4%) случаях отмечено одномоментное потребление водки и пива; преимущественно вино потребляли шесть человек (в том числе двое сочетали его с пивом); один пациент сообщил о потреблении алкогольных напитков различной крепости.
У пациентов были исключены генетически детерминированные заболевания, ассоциированные с ЖБП: болезнь Вильсона – Коновалова (исследован уровень церулоплазмина крови), врожденная недостаточность α1-антитрипсина (выявление двух мутаций гена SERPINA1 – G264V и G342L), гемохроматоз (наличие мутаций в гене HFE (в локусах 187 C>G (H63D) и 845 G>A (C282Y)). Определение антител ANA, SMA и AT-LKM-1 позволило исключить аутоиммунный гепатит. Лекарственный анамнез и отмена возможного препарата, формирующего липопротеины промежуточной плотности, обеспечили исключение лекарственного гепатита. У пациентов не было длительного (более двух недель) парентерального питания как возможной причины развития ЖБП.
У больных с НАЖБП и ЖБП смешанного генеза выявлены проявления метаболического синдрома, которые были оценены по следующим критериям: основной критерий – центральный (абдоминальный) тип ожирения, окружность талии более 94 см; дополнительные критерии – артериальное давление более 130/85 мм рт. ст. или лечение артериальной гипертензии препаратами; повышение уровня триглицеридов (≥ 1,7 ммоль/л); снижение уровня холестерина липопротеинов высокой плотности (ХС ЛПВП) (< 1,0 ммоль/л); повышение содержания ХС липопротеинов низкой плотности (ЛПНП) > 3,0 ммоль/л; концентрация глюкозы плазмы натощак ≥ 6,1 или 7,8 ммоль/л через два часа после нагрузки глюкозой. Достоверным метаболический синдром считали при наличии трех критериев: одного основного и двух дополнительных [27].
В качестве группы сравнения отобраны мужчины, проходившие профилактическое обследование, – 28 человек (средний возраст – 47,3 ± 2,7 года), ведущих здоровый образ жизни, употребляющих алкоголь не чаще одного-двух раз в месяц в дозах, не превышающих 20 г в сутки в пересчете на чистый этанол, без манифестирующей патологии внутренних органов и проявлений метаболического синдрома.
Пациенты с ЖБП и мужчины группы сравнения исключались из исследования, если они получали какие-либо добавки омега-3 полиненасыщенных жирных кислот (ПНЖК) или статины, имели гиперлипидемию, которая могла потребовать лекарственной коррекции, значительные отклонения по данным исследования общего анализа крови или биохимии крови или имели холестериновые камни в желчном пузыре, поскольку эти факторы оказывают существенное влияние на профиль ЖК мембран эритроцитов [29].
Всем обследованным выполнено исследование био-химических показателей, включая определение печеночных проб, параметров липидного профиля; определены индексы NAFLD liver fat score, Caro. Индекс NAFLD liver fat score рассчитывали по формуле NAFLD - LFS = -2,89 + 1,18 × (метаболический синдром: да – 1, нет – 0) + 0,45 × (сахарный диабет второго типа (СД 2): да – 2, нет – 0) + 0,15 × (содержание инсулина, мкЕд/мл) + 0,04 × (активность АСТ, Ед/л ) – 0,94 × АСТ/АЛТ [30]. Индекс Caro подсчитан как соотношение содержания глюкозы (ммоль/л) и инсулина (мкМЕ/мл) в плазме крови натощак [24].
У всех обследованных методом непрямой эластометрии на аппарате FibroScan® 502 (Echosens, Франция) определена степень выраженности фиброза печени с разграничением стадии фиброза по шкале METAVIR от F0 до F4. У пациентов основной группы с ЖБП она не превышала степень I, в группе сравнения соответствовала F0.
Исследование состава ЖК мембран эритроцитов проведено с помощью газовой хроматографии/масс-спектрометрии – системы на основе трех квадруполей Agilent 7000B (США). Концентрации ЖК выражали в относительных процентах. Предел обнаружения ЖК ~ 1 мкг на образец. Подробное описание пробоподготовки для исследования ЖК и процесса их определения представлено в работе [31]. Кроме содержания отдельных ЖК, определяли суммарное содержание насыщенных (НЖК), ненасыщенных (ННЖК), ПНЖК, омега-3 ПНЖК, омега-6 ПНЖК, их соотношения.
Выполнение настоящего исследования одобрено комитетом биомедицинской этики НИИТПМ – филиала ФИЦ ИЦиГ СО РАН (протокол № 11 от 2.03.2021). Все пациенты подписали информированное согласие на участие в исследовании.
Статистическая обработка данных выполнена с использованием программы IBM SPSS Statistics (версия 26.0) (StatSoft Inc, США). Определяли характер распределения количественных признаков методом Колмогорова – Смирнова. В случае нормального распределения вычисляли среднее значение (М) и стандартную ошибку среднего значения (m). При сравнении двух нормально распределенных выборок использовали t-тест Стьюдента. При отсутствии нормального распределения вычисляли медиану (Me), 25 и 75% процентили (25%; 75%) (Me (25%; 75%)) достоверность различия показателей оценивали с помощью непараметрических критериев (U-критерий Манна – Уитни, Краскела – Уоллиса).
Для установления уровней жирных кислот – возможных дифференциально-диагностических маркеров ЖБП различного генеза проведена процедура нормализации уровней показателей. Различия между уровнями жирных кислот в исследуемых группах выявляли с использованием дискриминантного анализа методом наименьших квадратов (Partial least squares-discriminant analysis – ortho PLS-DA). Для выявления уровней жирных кислот мембран эритроцитов, являющихся дифференциально-диагностическими биомаркерами, использованы непарный (сравнение уровней параметров групп больных попарно) t-тест и метод Volcano plot (система методов машинного обучения – Random Forest) с применением программного обеспечения MATLAB (R2019a, Math Works) и языка программирования R с использованием стандартных библиотек обучающих классификаций и наборов инструментов статистики [32]. Оценка диагностической точности показателей в качестве биомаркеров, дифференцирующих этиологию ЖБП, произведена с помощью ROC-анализа.
Результаты
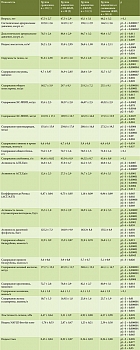
Клинико-биохимическая характеристика обследованных групп представлена в табл. 1. Все пациенты с НАЖБП и смешанным генезом ЖБП продемонстрировали наличие признаков метаболического синдрома – абдоминального ожирения, артериальной гипертензии, гипертриглицеридемии, гиперхолестеринемии, установлено статистически значимое повышение содержания инсулина, глюкозы крови натощак, мочевой кислоты (табл. 1). Величина индекса Caro менее 0,33 свидетельствовала о наличии инсулинорезистентности у всех пациентов с НАЖБП и смешанным генезом заболевания. Значения шкалы содержания жира в группе с НАЖБП и смешанным генезом ЖБП (NAFLD liver fat score), связанной с инсулинорезистентностью, превышающие 0,64, подтверждали наличие стеатоза [33].
Активность большей части печеночных ферментов (трансаминаз, гамма-глутамилтранспептидазы, щелочной фосфатазы), содержание общего билирубина, железа сыворотки крови, отражающих повреждение печени, у пациентов с ЖБП оказались выше, чем в группе сравнения, находясь в пределах референтных значений или с минимальными отклонениями от них. Данный факт не исключает наличия активного воспаления в печени, то есть стеатогепатита [34]. Содержание общего белка и альбумина у пациентов с ЖБП было сопоставимо со значениями у мужчин группы сравнения, что свидетельствует о сохранности белково-синтетической функции печени. Исследованная с помощью метода непрямой эластометрии эластичность печени имела тенденцию к увеличению у пациентов с НАЖБП, смешанным генезом ЖБП по сравнению с группой здоровых мужчин, что не исключает наличия начальных стадий фиброза с учетом применения в данной группе для исследования датчика XL [35, 36]. У пациентов с алкогольным генезом ЖБП плотность печени оказалась достоверно выше, чем в контроле (p = 0,028), что свидетельствует о высоком потенциале этанола как фактора фиброгенеза [12].
Пациентам исследуемых групп проведено определение относительного уровня ЖК мембран эритроцитов, после чего полученные значения подверглись нормализации (рис. 1).
Анализ содержания жирных кислот в мембранах эритроцитов в паре «неалкогольная жировая болезнь печени – алкогольная болезнь печени»
При проведении анализа в паре «НАЖБП – АЖБП» был установлен перечень жирных кислот мембран эритроцитов, представленный в табл. 2. Ими оказались элаидиновая, 9-пальмитолеиновая ЖК, эйкозапентаеновая ЖК, уровень которых был выше в мембранах эритроцитов при алкогольном генезе по сравнению с неалкогольным (p = 0,041–0,058). Содержание маргариновой, стеариновой и альфа-линоленовой кислот было выше у пациентов с НАЖБП, чем при АЖБП (p = 0,043–0,05).
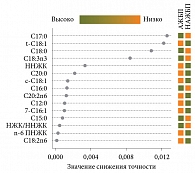
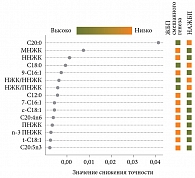
На рис. 2 представлено ранжирование жирных кислот в зависимости от их вклада в различение АЖБП и НАЖБП, выполненное с использованием непарной статистики при помощи метода Random Forest, на рис. 3 представлены результаты ROC-анализа.
В соответствии с данными рис. 3 диагностическая ценность отдельных жирных кислот для дифференцирования НАЖБП от АЖБП невысока: элаидиновая ЖК обеспечивает достаточную специфичность – 85,2% при невысокой чувствительности, а маргариновая и эйкозапентаеновая – более высокие уровни чувствительности (65 и 70% соответственно), чем специфичности. Использование панели жирных кислот, включающей перечень соединений: C18:1;t9, C17:0, С18:0, С18:3 n-3, С16:1;9, С20:5 n-3 – обеспечивает высокую диагностическую точность с AUC 0,914, чувствительностью 81%, специфичностью 93% при различении НАЖБП от АЖБП.
Анализ содержания жирных кислот в мембранах эритроцитов в паре «жировая болезнь печени смешанного генеза – неалкогольная жировая болезнь печени»
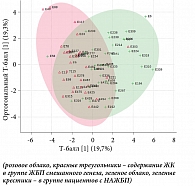
Дискриминантный анализ (ortho PLS-DA) продемонстрировал наличие жирных кислот, уровни которых статистически значимо различаются в паре «ЖБП смешанного генеза против НАЖБП» (рис. 4).
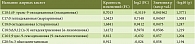
Использование метода Volcano plot обеспечило установление перечня ЖК – потенциальных биомаркеров для различения пациентов с ЖБП смешанного генеза и больных с НАЖБП (табл. 3).
На рис. 5 представлено ранжирование вклада отдельных ЖК в различение между пациентами с ЖБП смешанного генеза и НАЖБП.
При использовании метода Volcano-plot удалось выявить 14 жирных кислот мембран эритроцитов – потенциальных биомаркеров для различения ЖБП смешанного генеза и НАЖБП. Общий тренд – высокие уровни ненасыщенных ЖК (как моно-, так и полиненасыщенных) у пациентов с ЖБП смешанного генеза и более низкое содержание насыщенных ЖК по сравнению с НАЖБП. Так, общее содержание ненасыщенных, мононенасыщенных ЖК, уровни арахидоновой (n-6), олеиновой, эйкозапентаеновой (n-3), пальмитолеиновой, элаидиновой ЖК, суммарное содержание двух n-3 ПНЖК – эйкозапентаеновой и докозагексаеновой – у пациентов с ЖБП смешанного генеза оказались достоверно выше, а уровни стеариновой, суммарного содержания насыщенных, арахиновой ЖК и соотношения НЖК/ННЖК, НЖК/ПНЖК – ниже, чем у пациентов с НАЖБП.
Таким образом, алкоголь как дополнительный этиологический фактор обеспечивает большие уровни ненасыщенности в мембранах эритроцитов, причем как омега-3, так и омега-6 ПНЖК и мононенасыщенных.
Анализ содержания жирных кислот в мембранах эритроцитов в паре «жировая болезнь печени смешанного генеза – алкогольная болезнь печени»
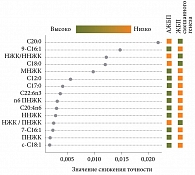
В табл. 4 представлены наиболее значимые жирные кислоты для различения пациентов с ЖБП смешанного генеза и АЖБП, а на рис. 6 установлена степень значимости вклада отдельных жирных кислот в дифференцирование между группами.
В различении пациентов с ЖБП смешанного генеза от ЖБП алкогольного генеза значимыми оказались девять жирных кислот мембран эритроцитов. При этом отмечена та же тенденция, что и в паре «ЖБП смешанного генеза против НАЖБП», – больший уровень ненасыщенных и меньший насыщенных ЖК при смешанном генезе по сравнению с алкогольным. У пациентов с ЖБП смешанного генеза достоверно выше суммарное содержание мононенасыщенных ЖК, особенно олеиновой и пальмитолеиновой, омега-6 ПНЖК – линолевой и насыщенной лауриновой, чем при АЖБП. Напротив, уровни насыщенных ЖК арахиновой, стеариновой, соотношения НЖК/ННЖК, НЖК/ПНЖК оказались выше при АЖБП, чем при ЖБП смешанного генеза.
Обсуждение
Одним из факторов, приводящих к прогрессированию ЖБП, является токсическое действие свободных жирных кислот, уровень которых в определенной степени коррелирует с жирно-кислотным профилем мембран эритроцитов [37]. В настоящем исследовании изучены особенности жирно-кислотного состава мембран эритроцитов у пациентов с ЖБП различного генеза, поскольку состав ЖК мембран эритроцитов считается более стабильным, чем уровни жирных кислот сыворотки крови, в связи с большей зависимостью последних от диетических привычек [38]. В работу включены пациенты с начальной стадией ЖБП – стеатозом и начальными стадиями фиброза печени, поскольку важно понимание ранних сдвигов в липидных метаболитах, когда заболевание обратимо. В проведенных ранее исследованиях мы проанализировали особенности жирных кислот мембран эритроцитов пациентов с ЖБП различного генеза в отличие от здоровых лиц [39, 40, 41], поэтому в данной статье сосредоточили внимание на имеющихся различиях между нозологическими формами заболевания.
В настоящем исследовании смешанный генез ЖБП ассоциирован с большей степенью ненасыщенности жирных кислот мембран эритроцитов, чем у пациентов только с алкогольной или неалкогольной этиологией процесса. Вероятно, это определяет большую готовность к активации ПОЛ из-за большого количества двойных связей, а поэтому к большему провоспалительному, профиброгенному потенциалу [12].
При сравнении перечня жирных кислот, оказавшихся значимыми для дифференцирования ЖБП смешанного генеза от неалкогольного или алкогольного, оказалось, что часть жирных кислот мембран эритроцитов совпала для обеих пар «смешанный генез против НАЖБП» и «смешанный генез против АЖБП». Ими были суммарное содержание мононенасыщенных жирных кислот, уровни олеиновой, арахиновой, стеариновой, пальмитолеиновой, лауриновой ЖК, отношения НЖК/ННЖК, НЖК/ПНЖК.
Исследование на мышах R. Guo и соавт. показало, что обогащение диеты мононенасыщенными ЖК значительно усугубляло вызванную алкоголем дисфункцию печени, о чем свидетельствовали гистологические данные и нарушенные биохимические показатели. Сочетание повышенного уровня мононенасыщенных ЖК с алкоголем снижали экспрессию гормон-чувствительной липазы (HSL), фосфорилированной 5'-AMP-активируемой протеинкиназы (p-AMPK) и карнитинпальмитоилтрансферазы-Ia (CPT1a) и повышало экспрессию в печени белка, связывающего стерол-регуляторный элемент-1c (SREBP-1c), диацилглицеролацилтрансферазы-2 (DGAT2) и рецептора липопротеидов очень низкой плотности (VLDLR). Подобное сочетание этиологических факторов также способствовало экспрессии печеночного интерлейкина 6 (ИЛ-6) и ФНО-α на транскрипционном уровне. Кроме того, липолиз жировой ткани частично оказывал этиологическое воздействие на вызванный алкоголем стеатоз печени при предварительном поступлении повышенного уровня мононенасыщенных ЖК. Авторы заключили, что повышенный уровень мононенасыщенных ЖК усугублял дисфункцию печени, вызванную алкоголем, in vivo [42]. Таким образом, повышенные уровни мононенасыщенных ЖК, выявленные в настоящем исследовании, могут быть дополнительными факторами прогрессирования АЖБП.
В ряде исследований показана различная роль отдельных насыщенных жирных кислот при ЖБП. Так, V. Saraswathi и соавт. в эксперименте на мышах показали, что маркеры воспаления жировой ткани (MCP-1 и ИЛ-6), системной инсулинорезистентности и стеатоза печени были статистически значимо выше при повышенных уровнях пальмитиновой, но не лауриновой ЖК у мышей с ЖБП [43]. W. Yoo и соавт. показали, что сывороточные уровни 15:0, 17:0 отрицательно коррелировали с показателями активности НАЖБП (баллонной дистрофией гепатоцитов, степенью фиброза печени) и увеличением объема гепатоцитов. В эксперименте на мышах авторы установили, что животные, получавшие диету с добавлением С15:0, показали снижение уровня АСТ и инфильтрацию печени макрофагами, насыщенными цероидами, по сравнению с мышами, не получавшими пентадекановую ЖК, что позволило предположить, что дефицит С15:0 способствует повреждению печени при неалкогольном стеатогепатите [44]. Было показано, что как 15:0, так и 17:0 имеют положительную связь со здоровьем и, в частности, с риском развития СД 2 и сердечно-сосудистых заболеваний [45–47].
Для пары «смешанный генез против НАЖБП» продемонстрировали значимость в различении суммарное содержание насыщенных, ненасыщенных ЖК, арахидоновая (n-6), эйкозапентаеновая (n-3), элаидиновая, а также суммарный уровень двух омега-3 ПНЖК – эйкозапентаеновой и докозагексаеновой. Эти жирные кислоты не были значимы для дифференцирования пациентов со смешанным генезом от АЖБП. В этой паре сыграла роль лишь одна омега-6 ПНЖК – линолевая, кроме перечня совпадающих с парой «смешанный генез против НАЖБП». Следовательно, в паре «смешанный генез против НАЖБП» больше дифференцирующих жирных кислот, чем в паре «смешанный генез против АЖБП».
В некоторых работах показано, что низкий уровень омега-3 (n-3) ПНЖК, включая α-линоленовую кислоту (18:3 n-3), в сыворотке крови и биоптатах ткани печени является общей характеристикой пациентов с алкогольной и неалкогольной болезнью печени [48, 49]. Возможно, добавление n-3 ПНЖК могло бы ослабить стеатоз печени, вызванный воздействием алкоголя. Все большее число исследований посвящено роли длинноцепочечных n-3 ПНЖК (эйкозапентаеновой кислоты (EPA, 20:5 n-3), докозагексаеновой кислоты (DHA, 22:6 n-3)) при алкогольном стеатозе печени [50–56]. Однако результаты этих работ противоречивы. В нескольких исследованиях сообщалось, что рыбий жир или длинноцепочечные n-3 ПНЖК защищают от развития стеатоза, вызванного алкоголем [51–53]. В ряде работ показано, что рыбий жир способствует патогенезу вызванного этанолом стеатоза печени и повреждению печени [54, 55]. Данные, полученные на моделях грызунов с алкогольной болезнью печени, продемонстрировали негативное воздействие омега-6 полиненасыщенных жирных кислот (n-6 ПНЖК), в частности линолевой кислоты, что может быть частично объяснено повышенными уровнями ее провоспалительных окисленных метаболитов, образующихся по липоксигеназному пути [56, 57].
Заключение
Выявлены перечни жирных кислот мембран эритроцитов, значимых для дифференцирования пациентов с ЖБП различного генеза между собой.
При анализе содержания ЖК в паре «АЖБП – НАЖБП» оказалось, что уровни элаидиновой, 9-пальмитолеиновой, эйкозапентаеновой жирных кислот выше (p = 0,041–0,058), а содержание маргариновой, стеариновой и альфа-линоленовой кислот (p = 0,043–0,05) ниже при алкогольном генезе по сравнению с неалкогольным. Использование панели жирных кислот, включающей перечень соединений: C18:1;t9, C17:0, С18:0, С18:3 n-3, С16:1;9, С20:5 n-3, обеспечило высокую диагностическую точность с AUC 0,914, чувствительностью 81%, специфичностью 93% при различении НАЖБП от АБП.
При анализе уровней жирных кислот в паре «ЖБП смешанного генеза – НАЖБП» установлено, что суммарное содержание ненасыщенных, мононенасыщенных, уровни арахидоновой (n-6), олеиновой, эйкозапентаеновой (n-3), пальмитолеиновой, элаидиновой, суммарное содержание двух n-3 ПНЖК – эйкозапентаеновой и докозагексаеновой – у пациентов с ЖБП смешанного генеза статистически значимо выше, а уровни стеариновой, суммарного содержания насыщенных, арахиновой и соотношений НЖК/ННЖК, НЖК/ПНЖК – ниже, чем у пациентов с НАЖБП (p = 0,000004–0,04).
Рассмотрение концентраций ЖК в паре «ЖБП смешанного генеза – АЖБП» позволило установить, что у пациентов с ЖБП смешанного генеза значимо выше суммарное содержание мононенасыщенных ЖК, особенно олеиновой и пальмитолеиновой, омега-6 ПНЖК – линолевой и насыщенной лауриновой, и ниже уровни НЖК – арахиновой, стеариновой, соотношения НЖК/ННЖК, НЖК/ПНЖК, чем при АЖБП (p = 0,0009–0,06).
Выявленные различия перспективны для продолжения исследований в данном направлении для создания новых подходов к дифференциальной диагностике ЖБП и новых таргетов для терапии.
Работа выполнена по государственному заданию в рамках бюджетной темы «Эпидемиологический мониторинг состояния здоровья населения и изучение молекулярно-генетических и молекулярно-биологических механизмов развития распространенных терапевтических заболеваний в Сибири для совершенствования подходов к их диагностике, профилактике и лечению» (FWNR-2022-0024). «Совершенствование методов диагностики, профилактики и лечения больных распространенными заболеваниями гепатобилиарной системы и желудочно-кишечного тракта в Сибири» (FWNR-2023-0003).
Авторы выражают глубокую благодарность научному сотруднику лаборатории физиологически активных веществ ФГБУН «Новосибирскоий институт органической химии им. Н.Н. Ворожцова СО РАН», к.х.н. А.С. Соколовой за помощь в подготовке образцов для проведения исследования жирных кислот эритроцитов; научному сотруднику аналитической лаборатории ФГБУН «Институт катализа им. Г.К. Борескова СО РАН», к.х.н. М.В. Шашкову за исследование уровня жирных кислот.
M.V. Kruchinina, PhD, M.F. Osipenko, PhD, Prof., M.V. Parulikova, E.V. Kruchinina
Research Institute of Internal and Preventive Medicine – Branch of the Institute of Cytology and Genetics, Siberian Branch of the Russian Academy of Sciences, Novosibirsk
Novosibirsk State Medical University
Contact person: Margarita V. Kruchinina, kruchmargo@yandex.ru
The purpose of the study: to study the possibilities of using fatty acids of erythrocyte membranes in differentiating patients with fatty liver disease of alcoholic, non-alcoholic and mixed genesis (metabolic + alcohol).
Material and methods. 38 men (average age 47.5 ± 2.9 years) with non-alcoholic fatty liver disease (NAFLD); 31 men with alcoholic fatty liver disease (AFLD) (45.1 ± 3.1 years) and 30 men (48.2 ± 3.2 years) with fatty liver disease of mixed genesis (metabolic + alcoholic) were examined. The degree of fibrosis in the groups did not exceed grade I. The composition and levels of the fatty acids (FA) of erythrocyte,s membranes were studied using gas chromatography/mass spectrometry, a system based on three Agilent 7000B quadrupoles (USA). Results. The levels of elaidic, 9-palmitoleic, eicosapentaenoic fatty acids were higher (p = 0.041–0.058), and the content of margaric, stearic and alpha-linolenic acids (p = 0.043–0.05) were lower in alcoholic genesis compared with non-alcoholic. The use of a panel of fatty acids – C18:1;t9, C17:0, C18:0, C18:3 n-3, C16:1;9, C20:5 n-3 – provided high diagnostic accuracy with an AUC of 0.914, sensitivity of 81%, specificity of 93% when distinguishing NAFLD from AFLD. It was found that the total content of unsaturated, monounsaturated, levels of arachidonic (n-6), oleic, eicosapentaenoic (n-3), palmitoleic, elaidic, the total content of two n-3 PUFA – eicosapentaenoic and docosahexaenoic in patients with mixed-genesis fatty liver disease were statistically significantly higher, and the levels of stearic, the total content of saturated, arachinic and the ratios of saturated FA/unsaturated FA, saturated FA/polyunsaturated FA were lower than in patients with non–alcoholic fatty liver disease (p = 0.000004–0.04). In patients with fatty liver disease of mixed genesis, the total content of monounsaturated FA, especially oleic and palmitoleic, linoleic (n-6) and saturated lauric, were significantly higher, and the levels of saturated FA arachinic, stearic, SFA/USFA, SFA/PUFA ratios were lower than in AFLD (p = 0.0009–0.06).
Conclusion. The revealed differences in the levels of fatty acids of erythrocyte membranes in patients with fatty liver disease of various origins are probably associated with the main etiological factor and can be used to develop new diagnostic methods and targets for therapy.
