Меланома и беременность. Собственный клинический опыт
- Аннотация
- Статья
- Ссылки
- English
Введение
Меланома кожи – одно из самых часто диагностируемых онкологических заболеваний на фоне беременности. Ежегодно число случаев меланомы кожи неуклонно растет. За 2022 г. зарегистрировано 33 250 случаев меланомы кожи у женщин детородного возраста (15–49 лет) [1]. Меланома, ассоциированная с беременностью, – это меланома, диагностированная во время беременности или в течение 12 месяцев после родов [2].
На сегодняшний день нет достоверных данных об увеличении риска возникновения меланомы кожи или смерти на фоне беременности. В ретроспективном анализе десяти исследований, в которых приняли участие в общей сложности 5590 женщин, не обнаружено связи между беременностью и риском возникновения меланомы [3].
Хирургическое лечение пациенток с первичной меланомой кожи на фоне беременности должно проводиться согласно современным стандартам. Рекомендовано проведение биопсии сторожевого лимфоузла (БСЛУ) с использованием 99m-Tc [4]. Фактическая доза на плод при проведении БСЛУ, по разным оценкам, составляет 1,4–5 мГр (дозы до 50 мГр не увеличивают частоту пороков развития) [5]. Однако по данным опроса 290 врачей – членов EORTC, занимающихся лечением меланомы, более половины респондентов откладывают БСЛУ до родоразрешения, опасаясь отдаленных последствий [6]. И все же важно понимать, что решение о проведении БСЛУ в случае согласия пациентки должно приниматься консилиумом в составе акушеров-гинекологов и онкологов.
В Национальном медицинском исследовательском центре (НМИЦ) онкологии им. Н.Н. Блохина за последний год проведены три процедуры БСЛУ у беременных пациенток с меланомой кожи. Процедура проводилась с использованием лимфотропных препаратов, меченных 99m-Tc. Рекомендованная доза для проведения БСЛУ при меланоме кожи составляет от 10 до 120 МБк, для беременных пациенток была использована минимальная доза, которая вводилась за несколько часов до операции. Эффективная доза в случае подкожного введения препарата с максимальной рекомендованной радиоактивностью (200 МБк) составляет 0,8 мЗв (за весь период беременности допустимой считается доза до 5 мЗв) [7, 8].
Однако важно понимать, что при выявлении макро- и микрометастатических очагов адъювантная терапия беременным пациенткам при III стадии вне зависимости от триместра беременности на сегодняшний день не рекомендована в связи с классом препаратов (класс D по FDA – имеются сведения о тератогенном действии на плод, однако потенциальная польза, связанная с применением лекарственного препарата у беременных женщин, может оправдывать его использование, несмотря на потенциальный риск). Описан случай развития тяжелого гастроэнтероколита у ребенка в четырехмесячном возрасте после назначения его матери во время беременности пембролизумаба в адъювантном режиме в дозе 400 мг один раз в 21 день. Диагноз подтвержден результатами гистологического исследования, иммунофенотипирования, а также анализом уровня антител против белка программируемой клеточной гибели 1 (PD-1). Симптомы иммуноопосредованного гастроэнтероколита у младенца успешно купированы назначением преднизолона и инфликсимаба [9].
Для обследования беременных пациенток рекомендованы ультразвуковое исследование (УЗИ), магнитно-резонансная томография (МРТ) всего тела, по показаниям компьютерная томография (КТ) органов грудной клетки [5].
Клинический случай 1
Пациентка М. 35 лет обратилась к онкологу по месту жительства в мае 2020 г., когда отметила активный рост пигментного образования на коже поясничной области на 20-й неделе беременности. Выполнена эксцизионная биопсия, по данным гистологического исследования обнаружена узловая меланома с изъязвлением, толщина опухоли по Бреслоу 8 мм, митозы 25 на мм2.
В июне 2020 г. пациентка обратилась в НМИЦ онкологии им. Н.Н. Блохина. При УЗИ органов брюшной полости, малого таза и периферических лимфоузлов данных за отдаленные метастазы не получено, беременность 22–23 недели. Данная беременность у пациентки вторая, первая закончилась родами в 2014 г. Учитывая локализацию первичной опухоли, желание пациентки сохранить беременность и отказ от выполнения БСЛУ, выполнено иссечение послеоперационного рубца и в дальнейшем рекомендовано динамическое наблюдение.
По данным УЗИ, спустя месяц после эксцизионной биопсии в паховой области слева диагностированы патологически измененные лимфатические узлы размерами 21 × 16 и 21 × 12 мм, беременность 26–27 недель. Выполнена тонкоигольная аспирационная биопсия пахового лимфоузла, цитологически верифицирован метастаз меланомы. Получены результаты молекулярно-генетического исследования первичной опухоли – обнаружена мутация в гене BRAF V600E.
На консилиуме рекомендовано проведение паховой лимфаденэктомии слева под контролем акушеров-гинекологов в специализированном учреждении с возможностью оценки сердечной деятельности плода. В июле 2020 г. в Национальном медицинском исследовательском центре акушерства, гинекологии и перинатологии (НМИЦ АГП) им. академика В.И. Кулакова хирургами из отделения опухолей кожи отделения НМИЦ онкологии им. Н.Н. Блохина выполнена паховая лимфаденэктомия слева на 27-й неделе беременности. По данным гистологического исследования, в двух из пяти исследованных лимфоузлов диагностированы метастазы меланомы. Дальнейшая тактика обсуждалась на многопрофильном консилиуме. С учетом течения заболевания и отсутствия данных по безопасности проведения адъювантной терапии на фоне беременности пациентке предложено раннее родоразрешение. Пациентка отказалась от родоразрешения и продолжила динамическое наблюдение.
В сентябре 2020 г. произошли естественные роды на 36-й неделе беременности. Состояние ребенка удовлетворительное, 8/9 баллов по шкале Апгар. После выписки из роддома в сентябре 2020 г. выполнено контрольное обследование. По данным позитронно-эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ-КТ) от сентября 2020 г., определено множественное метастатическое поражение легких до 6 мм, обеих долей печени размерами до 23 мм, метастаз в Th10 позвонка. По данным МРТ головного мозга с внутривенным контрастированием, данных за отдаленные метастазы не получено. Лактатдегидрогеназа – 520 МЕ/л (норма до 450 МЕ/л), ECOG – 0 баллов.
В НМИЦ онкологии им. Н.Н. Блохина пациентке рекомендовано проведение комбинированной иммунотерапии по схеме ипилимумаб 3 мг/кг + ниволумаб 1 мг/кг один раз в 21 день. Однако спустя пять дней после полученных рекомендаций у пациентки появились жалобы на кашель с прожилками крови, выраженную слабость. По результатам дообследования состояние пациентки расценено как прогрессирование заболевания, в связи с чем рекомендовано назначение таргетной терапии по схеме дабрафениб 150 мг два раза в сутки и траметиниб 2 мг один раз в сутки в ближайшее время по жизненным показаниям.
С сентября 2020 г. пациентка начала получать таргетную терапию, переносимость была удовлетворительной, зарегистрированы пирексия 1-й степени, макуло-папулезная сыпь 1-й степени (CTCAE 4). По данным ПЭТ-КТ от октября 2020 г., диагностирован полный ответ.
Спустя год на фоне комбинированной таргетной терапии, по данным МРТ головного мозга от 17.12.2021, выявлены множественные метастатические очаги в головном мозге от 2 до 12 мм, расположенные преимущественно кортикально-субкортикально. Рекомендована попытка проведения комбинированной иммунотерапии. 27.12.2021 проведен один курс комбинированной иммунотерапии по схеме ипилимумаб 3 мг/кг + ниволумаб 1 мг/кг один раз в 21 день. В январе 2021 г. пациентка госпитализирована в отделение реанимации и интенсивной терапии (ОРИТ) с кровоизлиянием в головной мозг на фоне прогрессирования процесса, где спустя несколько дней скончалась.
Метастатическая меланома кожи
Пациентки, у которых во время беременности диагностировали метастатическую меланому (IV стадия), должны быть информированы о течении заболевания и необходимости лекарственной терапии, а также об отсутствии доказательной базы по безопасности этой терапии во время беременности.
В случае наличия мутации в гене BRAF можно рассматривать вариант комбинированной таргетной терапии. В доклинических исследованиях вемурафениб продемонстрировал низкую проницаемость через плацентарный барьер, в то время как дабрафениб оказался тератогенным и эмбриотоксичным. MEK-ингибиторы в доклинических испытаниях также оказались эмбриотоксичными и приводили к прерыванию беременности у животных [10]. В литературе описаны четыре случая терапии вемурафенибом у беременных с метастатической меланомой кожи на фоне беременности. В одном из описанных случаев развилась тяжелая кожная токсичность с преждевременными родами на 24-й неделе, пациентка умерла через 2,5 месяца после начала лечения от кровоизлияния в головной мозг, новорожденные выписаны через 95 дней после родов, при осмотре через 15 месяцев патологий у детей не выявлено [11, 12].
Ингибиторы контрольных точек также не рекомендованы во время беременности, учитывая роль молекул иммунных контрольных точек, включая PD-1 и CTLA-4, в обеспечении толерантности матери к плоду [13].
В литературе описаны четыре клинических случая беременности на фоне иммунотерапии ингибиторами контрольных точек и три клинических случая назначения иммунотерапии у пациенток с метастатической меланомой кожи во время беременности. Шесть из семи беременностей закончились преждевременными родами на 24–33-й неделе. У четырех детей от трех беременностей (одна пара близнецов) (42%) выявлены признаки задержки внутриутробного развития, у одного ребенка диагностирован врожденный гипотиреоз. Метастазы в плаценту обнаружены у одной пациентки. Все дети были живы, без отдаленных осложнений. Результаты лечения пациенток соответствовали ожидаемым для метастатической меланомы кожи при назначении иммунотерапии [11].
Что касается собственного опыта использования анти-PD-1-терапии на фоне беременности, то в одном случае беременность была прервана с учетом желания пациентки и распространенности заболевания (метастатического поражения печени) на сроке 14 недель с дальнейшим продолжением терапии ингибиторами контрольных точек в монорежиме и развитием частичного ответа. В другом клиническом случае пациентка отказалась от прерывания беременности, но вскоре после родов здорового ребенка пациентка скончалась по причине прогрессирования метастатической меланомы. Еще один клинический случай хотелось бы описать подробнее.
Клинический случай 2
У пациентки И. 36 лет в августе 2023 г. во время очередного скрининга на 17–18-й неделе третьей беременности выявлены образования в обоих яичниках. Выполнена лапароскопическая резекция левого яичника по месту жительства. По данным гистологического исследования, выявлено опухолевое образование яичника неясной природы. Пациентка направлена в НМИЦ онкологии им. Н.Н. Блохина. По данным пересмотра гистологического материала, в готовых препаратах кусочки ткани яичника с разрастанием опухоли солидно-альвеолярного строения. Для определения гистогенеза опухоли и дифференциальной диагностики опухоли стромы полового тяжа и метастаза меланомы проведено иммуногистохимическое исследование с антителами к vimentin, inhidbin, S100, melanA, PAN CK, SOX10, Ki67. Выявлены экспрессия опухолевыми клетками vimentin, S100, melanA, SOX10 и отсутствие экспрессии PAN CK и inhibin. Индекс пролиферативной активности Ki67 – 35%. Морфо-иммунофенотип опухоли яичника соответствует метастазу меланомы. По данным молекулярно-генетического исследования, выявлена мутация в гене BRAF V600E.
Из анамнеза пациентки известно, что в 2014 и 2021 гг. в частной клинике у нее были удалены несколько пигментных образований на коже туловища без гистологического исследования.
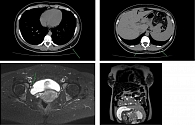
По данным КТ органов грудной клетки от сентября 2023 г., обнаружены уплотнение легочной ткани S1–S2 слева, очаги пневмофиброза обоих легких, очаговое образование нижнелатерального квадранта левой молочной железы размерами 17 × 11 мм и образование 23 × 20 мм на передней брюшной стенке. По данным МРТ органов брюшной полости и малого таза от 16.09.2023, выявлены образование яичников размерами до 10 мм (левый яичник резецирован), образование на правой стенке мочевого пузыря 9,5 × 10 мм, образования в мышцах до 17,5 мм (большие ягодичные, выпрямляющая позвоночник). Беременность 21–22 недели (рисунок). По данным МРТ головного мозга от 16.09.2023, данных за отдаленные метастазы не получено.
В НМИЦ АГП им. В.И. Кулакова проведен консилиум. Учитывая желание пациентки сохранить беременность и срок беременности 21–22 недели, а также то, что при досрочном родоразрешении по медицинским показаниям высока вероятность глубокой инвалидизации ребенка, рекомендовано назначение противоопухолевой терапии по жизненным показаниям с тщательным мониторингом состоянии плода и решением вопроса о времени и сроке родоразрешения. С пациенткой проведена разъяснительная беседа о возможных побочных явлениях и последствиях для плода на фоне проводимой противоопухолевой терапии. Консилиум в НМИЦ онкологии им. Н.Н. Блохина в составе специалистов отделения опухолей кожи и радиологов рекомендовал проведение комбинированной таргетной терапии. Однако пациентка обратилась в частную клинику, где ей было рекомендовано проведение иммунотерапии по схеме ниволумаб 480 мг один раз в 28 дней, с решением вопроса о добавлении ипилимумаба после родоразрешения.
В октябре 2023 г. проведено два курса иммунотерапии по схеме ниволумаб 240 мг внутривенно капельно один раз в 14 дней на фоне беременности 23–27 недель, переносимость – увеличение аланинаминотрансферазы и аспартатаминотрансферазы до 1,5 верхней границы нормы (1-я степень по CTCAE 5.0). В ноябре 2023 г. выполнено контрольное обследование в объеме МРТ органов брюшной полости и малого таза, в котором отмечено появление объемных образований в подкожно-жировой клетчатке, образований в параметрии, поражение левых подвздошных и мезоректальных лимфоузлов, рост очагов в проекции правого и левого яичников, рост образований в больших ягодичных мышцах, в правой мышце, выпрямляющей позвоночник.
Учитывая прогрессирование процесса, рекомендованы назначение комбинированной таргетной терапии и консультация акушера-гинеколога для решения вопроса о раннем родоразрешении.
В ноябре 2023 г. на 32-й неделе произошли преждевременные индуцированные роды. Состояние пациентки было удовлетворительным. Однако новорожденный ребенок переведен в ОРИТ по поводу пневмонии и нестабильной гемодинамики. Ему проведена антибактериальная, респираторная и кардиотоническая терапия с положительным эффектом. Спустя пять суток новорожденный ребенок находился на самостоятельном дыхании, на 16-е сутки в удовлетворительном состоянии выписан под наблюдение педиатра.
С января 2024 г. пациентка начала прием комбинированной таргетной терапии по схеме дабрафениб 150 мг два раза в сутки + траметиниб 2 мг один раз в сутки, переносимость – пирексия 1-й степени. По данным КТ органов грудной клетки, брюшной полости и малого таза от февраля 2024 г., уменьшение части очагов в мягких тканях, наибольшее в нижненаружном квадранте левой молочной железы – с 18 до 12 мм, на границе нижних квадрантов левой молочной железы – с 14 до 11 мм, очаг в легком стабилен, образование в полости мочевого пузыря стабильно, уменьшение очага в левом яичнике с 35 до 32 мм.
Обсуждение
Анализируя первый клинический случай, следует отметить, что беременным пациенткам с метастатической меланомой необходимо не откладывать обследование. Ограничение в выполнении КТ, ПЭТ/КТ с внутривенным контрастированием приводит к поздней диагностике метастатических очагов и, как следствие, позднему началу лекарственной терапии и отсутствию эффекта от лечения. Все риски прогрессирования заболевания обсуждались с пациенткой с самого начала лечебного пути, однако она категорически отказывалась от любых небезопасных для ребенка процедур. После родоразрешения в связи с отсрочкой проведения обследования до начала терапии у пациентки развились симптомы заболевания, что уже указывало на неблагоприятный прогноз. На фоне комбинированной таргетной терапии у пациентки зарегистрирован полный ответ, который сохранялся в течение 13 месяцев.
Второй клинический случай демонстрирует опыт назначения иммунотерапии ингибиторами контрольных точек на фоне беременности. От добавления ипилимумаба решено было воздержаться в связи с повышением риска выкидышей, мертворождений и преждевременных родов [14] и большим процентом нежелательных явлений. Спустя 1,5 месяца после начала терапии ниволумабом у пациентки появились новые метастатические очаги. После родоразрешения в связи с прогрессированием метастатического процесса пациентке была назначена комбинированная таргетная терапия. При изначальной распространенности метастатического процесса фактор отсрочки таргетной терапии привел к выраженному прогрессированию в дальнейшем. Новорожденный ребенок находился в отделении интенсивной терапии с диагнозом «врожденная пневмония», который, вероятно, объясняется недоношенностью. Связь с проводимой иммунотерапией сомнительна. Других пороков развития не обнаружено.
Заключение
Беременность не является фактором негативного прогноза для пациенток с меланомой кожи, что подтверждено различными исследованиями. На поздних стадиях диагностики меланомы этот вопрос является спорным вследствие ограниченных возможностей инструментальной диагностики и отсрочки начала лекарственной терапии при метастатическом процессе. При выявлении первичной меланомы на фоне беременности рекомендовано проведение хирургического лечения в полном объеме, в том числе и БСЛУ. Проведение адъювантной терапии не рекомендовано во время беременности, но, возможно, стоит рассматривать назначение лекарственной профилактической терапии после родоразрешения. При выявлении метастатической меланомы кожи пациентке может быть предложено прерывание беременности или раннее родоразрешение в зависимости от сроков, на котором выявлена метастатическая меланома. Проведение таргетной терапии и иммунотерапии на фоне беременности не рекомендовано, и опыт применения ограничен лишь единичными клиническими случаями.
Z.R. Magomedova, V.V. Nazarova, PhD, K.V. Orlova, PhD, I.V. Samoylenko, PhD, I.G. Markina, PhD, Ye.V. Ledin, PhD, V.A. Shamrikova, K.A. Baryshnikov, PhD, L.V. Demidov, PhD
N.I. Pirogov Russian National Research Medical University
N.N. Blokhin National Medical Research Center of Oncology
Medsi Clinical Hospital No. 2
Contact person: Zahra R. Magomedova, zahra.magomedova@gmail.com
The number of cases of melanoma of the skin is steadily increasing every year, which leads to an increase in cases of melanoma associated with pregnancy. To date, there is no convincing evidence of an increased risk of skin melanoma or death from melanoma during pregnancy, however, the treatment of such patients is not an easy task for oncologists. And if surgical treatment of patients with primary melanoma of the skin during pregnancy should be carried out according to modern standards, then the use of targeted drugs and checkpoint inhibitors has been little studied during pregnancy, therefore each individual case requires an individual approach. The article describes the clinical experience of the treatment of melanoma associated with pregnancy at the N.N. Blokhin National Research Medical Center of Oncology.
