Место препаратов сульфонилмочевины в сахароснижающей фармакотерапии
- Аннотация
- Статья
- Ссылки
- English
Современная сахароснижающая фармакотерапия направлена на достижение целевого контроля гликемии, предупреждение развития и прогрессирования диабетических осложнений. С учетом многочисленных патофизиологических механизмов гипергликемии для обеспечения и поддержания индивидуальной целевой гликемии по мере прогрессирования СД 2 типа требуется одновременное воздействие на различные нарушения. Многим больным необходима комбинированная терапия.
Обсуждается механизм действия препаратов сульфонилмочевины, а также возможность их комбинации с другими средствами. Рассматриваются место глибенкламида на этапе интенсификации терапии СД 2 типа, его фармакологические характеристики, преимущества и недостатки.
Современная сахароснижающая фармакотерапия направлена на достижение целевого контроля гликемии, предупреждение развития и прогрессирования диабетических осложнений. С учетом многочисленных патофизиологических механизмов гипергликемии для обеспечения и поддержания индивидуальной целевой гликемии по мере прогрессирования СД 2 типа требуется одновременное воздействие на различные нарушения. Многим больным необходима комбинированная терапия.
Обсуждается механизм действия препаратов сульфонилмочевины, а также возможность их комбинации с другими средствами. Рассматриваются место глибенкламида на этапе интенсификации терапии СД 2 типа, его фармакологические характеристики, преимущества и недостатки.


Введение
Сахарный диабет (СД) признан величайшей в истории человечества неинфекционной эпидемией с численным доминированием больных СД 2 типа [1–3].
Патология долгое время может протекать бессимптомно и выявляться на этапе развития опасных диабетических осложнений, что определяет необходимость более эффективных мероприятий по профилактике, диагностике и лечению [1, 3, 4].
Примерно у трети населения СД 2 типа не установлен. У части населения наблюдаются нарушенная толерантность к глюкозе или нарушение гликемии натощак, то есть предиабет. В течение этого скрытого периода дисгликемия и сопутствующие факторы риска развития сердечно-сосудистых заболеваний (избыточный вес/ожирение, артериальная гипертензия, дислипидемия) увеличивают бремя осложнений к моменту постановки диагноза, отягощая долгосрочный прогноз [5–8]. Велик и экономический урон, наносимый осложнениями СД 2 типа и преждевременной инвалидизацией [7–9]. В настоящее время не менее 12% общемировых трат на здравоохранение приходятся на СД [10, 11]. Присоединение диабетических осложнений повышает стоимость лечения в среднем в три – десять раз [12].
На сегодняшний день получены данные о долгосрочном влиянии раннего метаболического контроля на клинические исходы СД 2 типа, на основании которых была предложена концепция метаболической памяти, или эффекта наследия [13]. Именно поэтому оптимальное лечение СД с достижением и длительным поддержанием целевых метаболических показателей, осуществляемое с момента установления диагноза и в течение всей жизни пациента, признано эффективной мерой профилактики возникновения микро- и макрососудистых осложнений.
Метаболическая память – сохранение эффекта предшествующего гликемического контроля (хорошего или неудовлетворительного) в отношении развития и прогрессирования сосудистых осложнений [14, 15]. Данный феномен был отмечен в исследовании UKPDS. В частности, у лиц с впервые выявленным СД 2 типа интенсивный контроль гликемии в течение 7,5 года и снижение уровня гликированного гемоглобина (HbA1c) на 1% привели к уменьшению риска развития микроангиопатий на 37%, инфаркта миокарда на 14%, мозгового инсульта на 12%, ампутаций конечностей на 43% и смерти, связанной с диабетом, на 21% [16]. Эффекты раннего достижения целевой гликемии на фоне интенсивного лечения существенно превосходили эффекты достижения таковой после длительного периода неудовлетворительных показателей [17].
Необходимо также учитывать, что СД 2 типа является прогрессирующим заболеванием с последовательным ухудшением гликемии, обусловленным снижением секреторного потенциала β-клеток, от остаточной функции которых зависит успех любого терапевтического метода [4, 18].
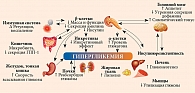
К основным патогенетическим механизмам СД 2 типа относят секреторный дефект β-клеток и инсулинорезистентность. Важное значение также отводится нарушению функции α-клеток, дефициту продукции и/или резистентности к инкретинам, вырабатываемым в желудочно-кишечном тракте, ускоренному липолизу в жировой ткани, повышению реабсорбции глюкозы в почках и резистентности к инсулину в мозге, нарушению кишечной микробиоты, хроническому воспалению [19]. Разнообразные патогенетические механизмы обусловливают целесообразность назначения комбинированной фармакотерапии, включающей два-три сахароснижающих препарата, что обеспечит поддержание и сохранение оптимального метаболического контроля по мере прогрессирования заболевания (рис. 1) [18–20].
В настоящее время выбор сахароснижающих препаратов (ССП) с различными механизмами действия довольно широкий: бигуаниды (метформин (МЕТ)), препараты сульфонилмочевины (ПСМ), тиазолидиндионы, глиниды (ГЛН), ингибиторы дипептидилпептидазы 4 (иДПП-4), ингибиторы натрий-глюкозного котранспортера 2 (иНГЛТ-2), инъекционные средства – агонисты рецепторов глюкагоноподобного пептида 1 (арГПП-1), инсулин [21, 22]. Однако многие из них не способны замедлить прогрессирующую потерю функции β-клеток [23].
Успехи в области диабетологии в большей степени обусловлены внедрением современных алгоритмов ведения пациентов с СД 2 типа, основанных на принципах персонализированной медицины. Согласно таковым, приоритетными при выборе ССП являются не только эффективность и безопасность, но и возможность влияния на клинические исходы. Следует также учитывать влияние препаратов на массу тела, их стоимость и предпочтения пациента [21, 22]. В Алгоритмах специализированной медицинской помощи больным сахарным диабетом подчеркивается важность выбора индивидуальных целей лечения в зависимости от возраста пациента, ожидаемой продолжительности жизни, функциональной зависимости, наличия атеросклеротических сердечно-сосудистых заболеваний (АССЗ) и риска тяжелой гипогликемии (табл. 1) [21]. В действующих алгоритмах лечения акцент делается на ССП с доказанным влиянием на прогноз и сердечно-сосудистую систему и почки – иНГЛТ-2 и арГПП-1. При наличии противопоказаний для их назначения или плохой переносимости, а также при необходимости интенсификации сахароснижающей терапии из-за неудовлетворительного контроля гликемии добавляются препараты других классов с предварительной оценкой их безопасности/нейтральности в отношении доминирующей клинической проблемы, а также с учетом рациональности комбинации [21–23].
Применение препаратов сульфонилмочевины
Широкое клиническое применение ПСМ началось еще в 50-х гг. прошлого столетия. Тем не менее они сохранили свои позиции в действующих алгоритмах лечения благодаря высокой эффективности, быстрому достижению сахароснижающего эффекта, невысокой стоимости, определяющей доступность препаратов [18, 23–25].
Эффективность и безопасность ПСМ продемонстрированы в многочисленных клинических исследованиях, в частности UKPDS (десятилетний период наблюдения), LAMBDA и др. [14, 26].
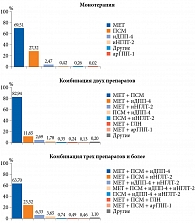
Одной из причин неудовлетворительного контроля заболевания считается несвоевременная интенсификация сахароснижающей фармакотерапии, или клиническая инертность [18, 24, 27]. В настоящее время ПСМ чаще используются на этапе интенсификации лечения в составе различных комбинаций. Так, согласно анализу структуры сахароснижающей терапии в РФ [1], наиболее часто назначаемыми двойными комбинациями являются «МЕТ + ПСМ» (82,9%), «МЕТ + иДПП-4» (11,7%) (рис. 2). На другие комбинации приходится небольшая доля случаев: на «МЕТ + иНГЛТ-2» – 2,7%, на «ПСМ + иДПП-4» – 1,8%, на «МЕТ + арГПП-1» – 0,1%. Доля новых классов препаратов возрастает в составе тройных комбинаций, при этом преимущественно с ПСМ и МЕТ: «МЕТ + ПСМ + иДПП-4» – 63,7%, «МЕТ + ПСМ + иНГЛТ-2» – 23,5%, «МЕТ + иДПП-4 + иНГЛТ-2» – 6,3%.
С учетом выбора ССП в зависимости от доминирующей клинической проблемы необходимо принимать во внимание, что использование ПСМ безопасно (нейтрально) при высоком риске развития АССЗ (возраст пациента 55 лет и старше, наличие стеноза коронарных, каротидных артерий или артерий нижних конечностей или гипертрофии левого желудочка), при наличии АССЗ (не рекомендован глибенкламид), хронической болезни почек (ХБП) (до С4 включительно, глибенкламид не рекомендован при скорости клубочковой фильтрации менее 60 мл/мин/1,73 м2). В случае хронической сердечной недостаточности ПСМ назначают с осторожностью (табл. 2) [21].
Механизм действия
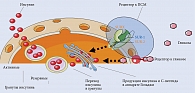
Молекулярный механизм действия ПСМ главным образом связан со стимуляцией β-клеток поджелудочной железы, сопровождающейся мобилизацией и усилением эндогенной секреции инсулина, особенно в присутствии глюкозы. Наличие в островках Лангерганса функционирующих β-клеток является основой для реализации сахароснижающего действия ПСМ [25]. Известно, что инсулин секретируется β-клетками в ответ на различные стимулы, каждый из которых вносит свой вклад в функционирование этих клеток. В настоящее время роль АТФ-зависимых К+-каналов β-клеток в регуляции секреции инсулина считается ключевой [25, 28]. Они состоят из двух компонентов – внутренней части калиевого канала (Kir6.2) и рецепторов сульфонилмочевины 1 (SUR-1). На клеточной мембране β-клеток ПСМ связываются со специфическими белками-рецепторами – SUR-1 (рис. 3). После взаимодействия ПСМ с SUR-1 происходит закрытие АТФ-зависимых К+-каналов с последующим прекращением трансмембранного потока ионов калия и деполяризацией мембраны β-клеток. В дальнейшем на фоне активации кальциевых каналов значительно увеличивается приток кальция внутрь β-клеток. Повышение концентрации ионов кальция внутри β-клеток способствует движению инсулиносодержащих гранул через их мембрану и последующей секреции инсулина в кровоток с реализацией биологических эффектов гормона [25, 29, 30].
Глибенкламид
Среди ПСМ наиболее выраженным сахароснижающим эффектом обладает глибенкламид, который продемонстрировал преимущества в достижении контроля гликемии и профилактике развития диабетических осложнений [26, 29, 31–33].
Высокая сахароснижающая активность препарата обусловлена максимальным сродством с АТФ-зависимыми K+-каналами β-клеток и особенностями его химической структуры: наличие не только сульфонилмочевинной, но и бензамидной группы. Взаимодействуя с двумя связывающими местами β-клеточных рецепторов, глибенкламид наиболее быстро способствует закрытию АТФ-зависимых К+-каналов, стимулирует деполяризацию мембраны, активирует кальциевые каналы [28, 32, 33]. Как следствие, возрастает концентрация внутриклеточного Са2+ и, следовательно, секреция эндогенного инсулина, особенно в присутствии глюкозы.
Глибенкламид снижает уровень HbA1c (до 2%), концентрацию глюкозы натощак и постпрандиальной (на 2,0–4,0 и 3,0–5,2 ммоль/л соответственно), что обеспечивает оптимальный контроль гликемии у пациентов с СД 2 типа [33–36].
Периферическое (экстрапанкреатическое) воздействие глибенкламида, по-видимому, вторично и обусловлено повышением инсулинемии и снижением глюкозотоксичности, что вызывает угнетение гепатической продукции глюкозы и улучшение ее утилизации периферическими тканями. Собственные экстрапанкретические эффекты убедительно не доказаны [28].
Доказано, что глибенкламид снижает риск развития хронических осложнений СД 2 типа.
Так, в масштабном исследовании UKPDS применение глибенкламида позволило снизить риск развития микрососудистых осложнений на 30% (р = 0,015), включая ретинопатию, требующую фотокоагуляции, – на 33% (р = 0,008).
Кроме того, глибенкламид способен влиять на макрососудистые осложнения. Так, препарат уменьшал частоту инфаркта у больных СД 2 типа на 22% (р = 0,056).
В настоящее время глибекламид чаще применяется для интенсификации сахароснижающей терапии в составе различных рациональных комбинаций [31–33, 36].
Как указывалось ранее, применение глибенкламида безопасно (нейтрально) при наличии высокого риска возникновения АССЗ. От его использования следует воздержаться при наличии АССЗ. Применение глибенкламида не рекомендовано при расчетной скорости клубочковой фильтрации менее 60 мл/мин/1,73 м2, а также при наличии хронической сердечной недостаточности [21, 22].
К основным недостаткам ПСМ относят их способность вызывать гипогликемии и прибавку массы тела, поэтому вопросы их безопасного применения остаются злободневными [21, 25, 34].
При применении любого ПСМ существует меньший или больший риск развития гипогликемий. Глибенкламид, обладая наибольшей аффинностью с АТФ-зависимыми K+-каналами β-клеток поджелудочной железы, оказывает значительный сахароснижающий эффект, что нередко служит причиной развития гипогликемических состояний [25, 30, 31]. Одной из причин гипогликемий является быстрое увеличение суточной дозы или неправильный ее подбор, а также нарушение режима питания пациентом (резкое ограничение употребления сложных углеводов, пропуск очередного приема пищи или отсутствие информированности о необходимости приема пищи после приема препарата) и нерациональная физическая нагрузка.
Глибенкламид метаболизируется с образованием неактивных и активных оксиметаболитов и выводится двумя путями: через почки и с желчью в равной пропорции – по 50% [34]. При хронической почечной недостаточности выведение глибенкламида не изменяется, однако снижается связывание с белками, вследствие чего возрастают свободная фракция препарата и риск развития гипогликемии.
У 85–90% больных СД 2 типа имеет место избыточная масса тела или ожирение. В ряде случаев нежелательным побочным эффектом терапии глибенкламидом, как и другими ПСМ, может быть прогрессирование ожирения. Этот риск можно уменьшить или предотвратить с помощью соблюдения рекомендаций по питанию и физическим нагрузкам [25, 35, 37].
Пациенты с СД 2 типа нередко страдают сопутствующей патологией, поэтому также необходимо принимать во внимание проблему лекарственного взаимодействия. Так, при назначении целого ряда препаратов за счет различных механизмов может наблюдаться как усиление, так и ослабление действия глибенкламида, как и других ПСМ. Снижают сахароснижающую активность глюкокортикоиды, барбитураты, фенотиазины, тиазидные диуретики, тиреоидные гормоны (супрессивная терапия), эстрогены, гестагены, адреномиметики, производные никотиновой кислоты, рифампицин, усиливают – салицилаты, сульфаниламиды, анаболические стероиды, пентоксифиллин, аллопуринол, хлорамфеникол, пиразолоновые производные, клофибрат, безафибрат, ингибиторы моноаминоксидазы, непрямые антикоагулянты, противогрибковые средства системного действия, спиртсодержащие лекарственные средства [34].
Необходимо также отметить, что ПСМ, будучи секретагогами, при длительном применении способствуют истощению функционального состояния β-клеток островков Лангерганса и ухудшению контроля гликемии. Для предотвращения более быстрого истощения β-клеточной функции нецелесообразно применять препараты этой группы на старте терапии СД [21, 22, 25, 35].
Разработка микронизированной (высокодисперсной) формы глибенкламида, позволяющей активному веществу быстрее абсорбироваться из желудочно-кишечного тракта, значительно улучшила возможности контроля гликемии и повысила безопасность терапии [38, 39]. Уменьшение размера частиц и увеличение площади поверхности повышают растворимость, за счет чего увеличиваются адсорбция в желудочно-кишечном тракте, биодоступность и клиническая эффективность препарата [40]. Полное высвобождение микронизированного активного вещества происходит в течение пяти минут, что обеспечивает почти 100%-ную биодоступность.
К преимуществам микронизированной формы глибенкламида следует отнести возможность использования меньших доз за счет большей биодоступности. Лучшее совпадение Cmax с пиком постпрандиальной гипергликемии обеспечивает лучший постпрандиальный эффект.
Кроме того, применение более низких доз способствует снижению риска возникновения гипогликемий [40, 41].
Укорочение периода всасывания при улучшении фармакокинетических свойств позволяет принимать препарат непосредственно перед приемом пищи.
Не менее важный вопрос – доступность и стоимость лечения [2, 24]. Применение глибенкламида оправданно не только с учетом его высокой эффективности, длительного опыта использования, но и с учетом относительной дешевизны по сравнению с другими современными сахароснижающими препаратами. Однако при условии, что такая терапия безопасна/нейтральна для пациента.
Высокую социальную значимость глибенкламида подчеркивают и эксперты Всемирной организации здравоохранения (ВОЗ). Так, препарат был включен в перечень Основных лекарственных средств ВОЗ 2019 г. Это наиболее эффективные, безопасные и выгодные с фармакоэкономической точки зрения средства для лечения социально значимых заболеваний. В данном перечне глибенкламид является единственным представителем ПСМ [42].
Противопоказаниями для назначения глибенкламида являются СД 1 типа, диабет вследствие панкреатэктомии, кетоацидоз, хирургические вмешательства (большие операции), тяжелые инфекции и травмы, аллергии на ПСМ или сходные с ними препараты в анамнезе, тяжелые нарушения функции почек и печени. Следует воздержаться от назначения препарата в период беременности и лактации.
Заключение
В настоящее время ПСМ сохраняют свои позиции в управлении СД 2 типа при сочетанной терапии с МЕТ или другими ССП на этапе интенсификации сахароснижающей фармакотерапии. Они обеспечивают длительный гликемический контроль при минимизации фармакоэкономических затрат. Применение в клинической практике микронизированной формы глибенкламида позволяет улучшить контроль гликемии и повысить безопасность терапии.
E.V. Biryukova, MD, PhD, Prof., D.V. Kileynikov
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinic Scientific Center
Contact person: Yelena V. Biryukova, lena@obsudim.ru
The medical and social significance of type 2 diabetes mellitus is conditioned by the epidemic rates of the prevalence of the disease and the development of complications leading to the decrease in the quality of life, early disability and the unfavorable prognosis. The presence of type 2 diabetes entails the need for lifelong pharmacotherapy and constant monitoring of glycemia. The addition of complications significantly increases the cost of treatment.
Modern hypoglycemic pharmacotherapy is aimed at achieving targeted glycemic control, preventing the development and progression of diabetic complications. Taking into account the numerous pathophysiological mechanisms of hyperglycemia, simultaneous exposure to various disorders is required to ensure and maintain individual target glycemia as type 2 diabetes progresses. Many patients need combination therapy.
Discussed the mechanisms of action of sulfonylurea preparations, as well as the possibility of their combination with other agents. Considered the place of glibenclamide at the stage of intensification of type 2 diabetes therapy, its pharmacological characteristics, advantages and disadvantages.
